編者按
前面已經有學者研究NAD+可以促進肝細胞活性:
這次中國科學家發現NMN可直接促進間充質幹細胞的擴增,刺激成骨分化並抑制脂肪細胞分化,減緩骨流失。
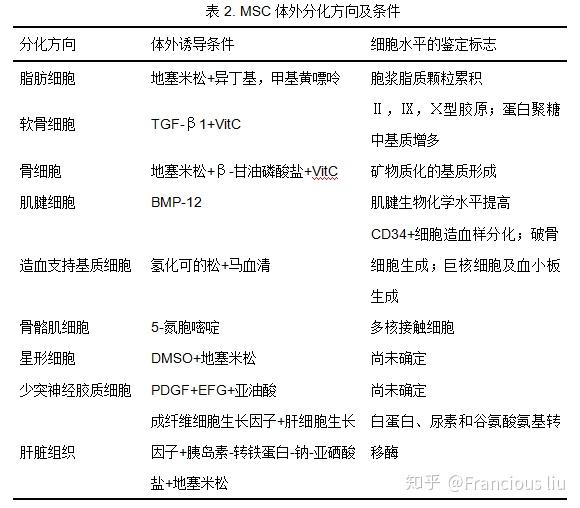
間充質幹細胞《mesenchymal stem cell,MSC》是幹細胞家族的『明星成員』,是一種具有自我復制能力和多向分化潛能的成體幹細胞,能夠分化成成熟細胞如成骨細胞,軟骨細胞和脂肪細胞等[1]。這種靈活分化的能力使MSC在組織修復與再生等領域備受關注。然而現有的MSC培養方法限制了MSC自我更新的潛力,導致治療結果不理想。
近日,中山大學附屬第三醫院的彭亮和謝嬋研究團隊探討了NMN通過調節間充質幹細胞《MSC》在治療年齡相關疾病中的作用,他們的研究成果發表在Cell Death & Diease 雜志上[2]。
首先,研究者分別從體外和體內研究了NMN對小鼠間充質幹細胞《MSC》的擴增和分化有無影響。
對NMN體外培養的小鼠BM細胞進行CFU-F測定顯示:
NMN劑量依賴性地促進了MSC的擴增;
體外結果顯示,NMN呈劑量依賴性促進MSC的擴增
而對給予NMN 3個月的小鼠的免疫表型MSC分析結果顯示:
與對照組《0.30±0.021%》相比,LepR+、CD45- 、Ter119-、 CD31-、 CD51+ 等基質細胞的表達率增加至0.51±0.024%,NMN顯著促進了小鼠體內外MSC的擴增。
體內結果顯示,NMN提高了MSC的生物標志物
現階段,大多數MSC的擴增方法需要頻繁和長時間的傳代培養,培養過程中容易導致增殖性衰竭、衰老、分化能力受損以及自發轉化導致的異質性[3]。而這項研究表明,NMN具有促進MSC擴增的能力,從而避免了體外培養的種種缺陷,減少長時間的傳代培養。
研究者接著探究了NMN對MSCs分化的影響,MSC在體外特定條件下可以定向誘導分化為成骨細胞、脂肪細胞和成軟骨細胞等,目前尚不清楚MSC在體內的特異性分化條件。
在體外實驗中,研究者在分化期間將NMN培養的CFU-F集落誘導成成骨細胞和脂肪細胞譜系,結果顯示,NMN處理的培養物中有更多的成骨細胞50%《對照組中約30%》,且脂肪細胞的分化顯著減少,濃度在0.75-2.25μM之間。qPCR結果更好地分析了這一現象產生的原因:NMN培養的細胞中,促進骨生成的關鍵轉錄因子《RunX2》的表達顯著增加,而關鍵脂肪生成轉錄因子《Pparg、Adipq28等》的表達水平下降。這表明NMN能刺激成骨分化,並抑制脂肪細胞的分化。
①圖上:成骨細胞增加;
②圖下:脂肪細胞降低。
而在體內,NMN對不同年齡段的小鼠改變分化比例的作用也不同。對老年小鼠《12月齡》而言,體內結果與先前的體外結果一致,NMN處理的MSCs以脂肪細胞譜系為代價,向骨譜系的偏向分化,在抑制脂肪細胞的同時刺激了老年小鼠的骨生成。
當骨髓間充質幹細胞以成骨為代價異常分化為脂肪細胞時,就會發生骨骼衰老和骨質疏松症,導致骨形成受損和骨量減少[4],而NMN能夠逆轉這一過程,為預防和治療老年骨科疾病提供可能。
而對成年小鼠《2月齡》而言, NMN沒有直接改變成年小鼠的骨脂平衡,但對受輻射損傷的成年小鼠有直接影響:電離輻射是導致骨質流失和MSCs損傷的重要因素,有研究發現,暴露於亞致死劑量的輻射會導致成骨細胞減少,骨髓中基質細胞衍生的脂肪細胞增多[5]。實驗中用NMN處理受輻射的MSC後,通過對骨切片的形態學分析,以及相關成骨基因和脂肪形成基因mRNA的表達分析發現,NMN有效促進了成年小鼠成骨細胞的恢復,並抑制MSC分化為脂肪。
①成骨基因RunX2和Wnt4的表達隨輻射降低約50%,
而在NMN處理後增強五倍;
②脂肪形成基因Adipq和Pparg的表達隨輻射增加約2倍,
而在NMN處理後受抑制。
並且,研究人員發現NMN對體內受輻射的MSCs有直接的保護作用,能夠通過促進MSCs的擴增來保護其免受輻射誘導的衰竭。
NMN處理使受輻射的MSC的CFU-F恢復到對照組水平
最後,研究者對NMN調節骨髓間充質幹細胞成骨和脂肪生成的機制做出了研究,他們根據『12個月齡的NMN組小鼠分選的基質細胞中,SIRT1蛋白質的表達增加了約兩倍』這一現象,進一步測試了NMN對15個月齡小鼠中MSCs的作用是否需要SIRT1,用SIRT1抑制劑煙酰胺進行體外培養後,MSCs的CFU-F和成骨能力受到抑制,而脂肪形成能力增加。ColA1floxstop-flox-SIRT1小鼠是一種在肢體MSC中過表達SIRT1蛋白的小鼠模型,與NMN組小鼠類似,這種小鼠的脂肪生成下降了33%,這些結果都表明SIRT1對於NMN促進骨生成和抑制MSC的脂肪形成至關重要。
油紅S染色結果顯示,
ColA1小鼠的股骨切片中脂肪細胞數低於對照
總結:
這項研究結果表明,NMN可以有效促進體內外MSCs的擴增,避免了體外培養的各種缺陷,有希望應用於改善MSCs的治療效果,擴大其臨床應用。此外,NMN還能促進老年小鼠與受輻射的成年小鼠的骨化,減緩衰老過程中的骨骼流失,是一種潛在的治療MSCs相關老年疾病的新手段。
參考文獻
[1] Erices,A.,J.J. Conget P Fau – Minguell,and J.J. Minguell,Mesenchymal progenitor cells in human umbilical cord blood. (0007-1048 (Print)).
[2] Jie Song,Jing Li,- Chan Xie and Liang Peng,Nicotinamide mononucleotide promotes osteogenesis and reduces adipogenesis by regulating mesenchymal stromal cells via the SIRT1 pathway in aged bone marrow.
[3] Aguilar,S. et al. Murine but not human mesenchymal stem cells generate osteosarcoma-like lesions in the lung. Stem Cells 25,1586–1594 (2007)
[4] Mandrup,S. & Lane,M. D. Regulating adipogenesis. J. Biolo. Chem. 272,5367–5370 (1997)
[5] Zhou,B. O.,Yue,R.,Murphy,M. M.,Peyer,J. G. & Morrison,S. J. Leptin-receptorexpressing mesenchymal stromal cells represent the main source of bone formed by adult bone marrow. Cell Stem Cell 15,154–168 (2014).