摘要
人口老齡化的快速增長對與年齡有關的疾病,包括AKI,帶來了挑戰,其患病率和死亡率都隨著年齡的增長而增加。衰老腎臟更易發生急性損傷的分子機制尚未完全闡明。在這項研究中,我們發現,與3月齡小鼠的腎臟相比,20月齡小鼠的腎臟表達的腎臟保護分子sirtuin1《SIRT1》及其輔因子NAD+水平降低。補充NAD+前體煙酰胺單核苷酸《NMN》可恢復20月齡小鼠的腎臟SIRT1活性和NAD+含量,並進一步增加3月齡小鼠的SIRT1活性和NAD+含量。此外,補充NMN顯著保護兩個年齡組的小鼠免受順鉑誘導的AKI。SIRT1缺陷減弱了NMN的保護作用,微陣列數據顯示SIRT1雜合子中c-Jun N末端激酶《JNK》信號激活與腎損傷相關。在體外,SIRT1通過調節JNK信號通路,可能通過JNK磷酸酶DUSP16的去乙酰化來減弱應激反應。綜上所述,我們的研究結果顯示SIRT1在腎臟老化過程中是一個重要的介導因子。此外,NMN對SIRT1活性的調控似乎是AKI的一種潛在藥物幹預,有助於老年AKI患者的精確治療。
大量文獻表明,AKI的發病率隨著年齡的增長而增加。1,2多項研究表明,年齡是AKI及其相關死亡率和發病率的獨立危險因素。1盡管年齡相關的共病和醫源性因素是導致這些結果的原因,年齡相關的細胞退化和腎細胞對應激的反應受損也被認為是增加腎臟對損傷的易感性的原因–4 –8
最近的研究表明sirtuin 1《SIRT1》在細胞對應激的反應中起著重要的作用,並且已經被證明可以延長壽命,至少在低等動物中是如此。9SIRT1,anNAD+依賴性脫乙酰酶,是sirtuin家族的一員,它有7個家族成員。SIRT1主要定位於細胞核,在那裡它去乙酰化許多細胞核蛋白質和轉錄因子。SIRT1已被證明是熱量限制相關健康益處的基礎,包括延長壽命和減少與年齡相關的惡化。12一直以來,SIRT1的激活劑,包括白藜蘆醇和合成SIRT1激活化合物,已被證明可促進實驗動物的健康,15盡管人類研究的結果有些不同,可能是因為其作用機制的復雜性–11 –14 –18 –22
NAD+介導線粒體內代謝途徑中的氫轉移和氧化還原反應。NAD+也被
被發現是包括SIRT1在內的幾種重要酶反應中不可或缺的輔助因子,支持SIRT1在調節細胞對代謝和氧化應激的反應中的重要作用。23積累研究表明,細胞NAD+水平隨著Aging26降低,並伴隨著SIRT1活性降低。5,14增加NAD+與延長壽命有關,26,29和用NAD+前體《如煙酰胺單核苷酸《NMN》和煙酰胺核糖》恢復NAD+糾正了許多問題–25 –28
代謝異常.30–33
在這項研究中,我們檢測了NAD+/SIRT1在老年動物對AKI易感性中的作用。我們的研究表明,老年小鼠腎臟的NAD+和SIRT1缺陷導致對順鉑誘導的AKI的易感性增加;NMN治療以SIRT1依賴的方式挽救了老年小鼠腎臟免受順鉑誘導的AKI。NAD+/SIRT1保護腎臟的機制涉及c-Jun N末端激酶《JNK》途徑的表觀遺傳調控。本研究揭示了年齡相關性AKI易感性的機制,並確定內源性NAD+是AKI的潛在治療靶點,尤其是在老年人中。
結果
老年腎易受順鉑誘導的AKI的影響。劑量為20mg/kg體重的順鉑成功誘導了129隻3月齡和20月齡小鼠的AKI。用BUN和血清肌酐《順鉑72h》評價腎功能。20月齡AKI小鼠的BUN和肌酐水平是3月齡小鼠的兩倍《圖1,A和B》。一直以來,腎臟的組織學研究顯示,20月齡小鼠的腎小管損傷明顯比3月齡小鼠嚴重,包括近端腎小管嚴重擴張、鑄型形成、腎小管上皮大量脫落和壞死《圖1D》。通過盲法測定順鉑作用72小時後受損腎小管的百分比進行病理分析,進一步證實老年腎臟易受毒素損傷《圖1C》。此外,電子顯微照片顯示,順鉑在3個月大的小鼠中誘導近曲小管線粒體輕度腫脹,而在20個月大的小鼠中,相同劑量的順鉑誘導線粒體碎裂成球形和部分嵴斷裂《圖1E》。
衰老與腎臟SIRT1表達和NAD+水平下降有關
在腎皮質組織中,SIRT1及其底物NAD+的mRNA和蛋白質表達隨著年齡的增長而減少《圖2,A–C,補充圖1》。20個月齡腎臟中SIRT1表達和NAD+含量約為3個月齡腎臟的三分之一。然後我們檢測了NAD+生物合成酶的表達:煙酰胺磷酸核糖轉移酶《NAMPT》,煙酰胺單核苷酸腺苷酸轉移酶1《NMNAT1》,NMNAT3.34實時PCR顯示,與3個月大的腎皮質相比,20個月大的腎皮質中所有這些酶的mRNA水平顯著降低《圖2D》。
補充NMN可保護腎臟免受與衰老相關的AKI易感性
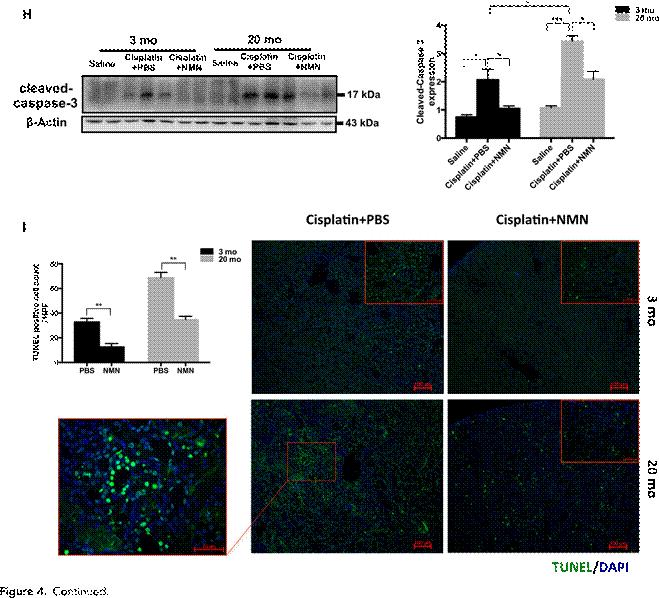
NMNI介導NAD+回收途徑。四天的NMN補充恢復了年輕和老年腎皮質中的NAD+水平《圖3A》,並進一步增加了SIRT1活性,如直接酶活性測量和降低的Foxo1乙酰化水平所示,Foxo1是SIRT1的下遊靶分子《圖3、B和C》。為了探討NMN是否能拯救衰老相關的AKI易感性,我們在順鉑暴露後立即給3個月齡和20個月齡的小鼠提供NMN。如圖4所示,與PBS對照組相比,NMN補充劑顯著減弱順鉑誘導的AKI。順鉑暴露後20月齡小鼠血清肌酐,NMN處理組較載體處理組降低60%。組織學顯示NMN處理的AKI小鼠的腎小管壞死和鑄型形成有所改善《補充圖2》。此外,NMN治療減少了順鉑誘導的細胞凋亡,這是通過減少切割的caspase-3表達和減少末端脫氧核苷酸轉移酶介導的地高辛脫氧尿苷缺口末端標記《TUNEL》陽性細胞來評估的。
SIRT1缺乏加重了順鉑誘導的AKI,以確定在衰老腎臟中觀察到的SIRT1水平較低是否易導致腎損傷惡化,我們在SIRT1雜合子中進行了SIRT1純合子對胚胎和圍產期致死率的研究,35與順鉑暴露後的野生型同窩仔相比,SIRT1基因的一個等位基因缺失顯著加重腎損傷,導致更高的BUN和血清肌酐水平、更多的腎小管損傷和更嚴重的線粒體斷裂《圖5,A-E》。通過半胱天冬酶-3的Western印跡、凋亡相關基因的實時PCR和TUNEL染色進一步證實增強的腎小管細胞損傷:SIRT1雜合子顯示更高的切割半胱天冬酶-3蛋白水平、BAX、半胱天冬酶-3和-9 mRNA表達以及更多TUNEL標記的凋亡細胞《圖5,F–I》。
NMN的作用依賴於SIRT1
為了確定NMN是否對SIRT1有保護作用,我們檢測了NMN對SIRT1缺陷小鼠的影響,以及用高劑量順鉑《30mg/kg體重》治療的同等損傷野生型小鼠的影響《補充圖3》。如圖6和補充圖4所示,NMN在野生型小鼠中保護腎臟免受嚴重腎損傷,但當SIRT1基因的一個等位基因被刪除時,這種治療效果顯著減弱。一致的體內數據也支持NMN以SIRT1依賴的方式挽救順鉑誘導的細胞死亡。
圖1。衰老加重順鉑引起的急性腎損傷。在生理鹽水或順鉑治療後72小時,通過《A》BUN和《B》血清肌酐評估指定組的腎功能《生理鹽水治療組n=5,順鉑治療組n=8》。《C》 用順鉑或生理鹽水處理的3個月齡和20個月齡小鼠腎臟中受損小管的百分比對組織損傷進行評分《n=6》。《D》 低倍和高倍鏡下蘇木精和伊紅染色的代表性切片。《E》 顯示並量化所示組中腎PTC的EM檢查。數據以平均6sem表示,並采用兩組間的非配對t檢驗和多組間的方差分析進行分析,然後進行後測。比例尺,2 mm。*P、 0.05;**P,0.01。
圖2。衰老腎臟中SIRT1表達和NAD+水平降低。《A》 3月齡和20月齡129隻小鼠腎皮質SIRT1的相對mRNA表達《n=6》。《B》 腎皮質SIRT1蛋白表達的典型Western印跡圖像。b-肌動蛋白作為負荷對照。《C》 NAD+水平和《D》3月齡和20月齡129隻小鼠《n=6》腎皮質NAMPT、NMNAT1和NMNAT3的相對mRNA表達。數據用平均6SEM表示,並用未配對學生的問卷進行分析
t檢驗。*P、 0.05;****P,0.001。
NMN治療對腎缺血再灌註損傷的保護作用
我們進一步在附加的AKI模型中驗證了NMN的治療效果;在野生型小鼠中誘導22分鐘的雙側再灌註,並在術前和再灌註24小時後給予NMN或PBS。再灌註48小時後進行腎功能及組織學分析。如圖7所示,與PBS治療的小鼠相比,NMN治療的小鼠BUN和血清肌酐水平要低得多,腎小管損傷也有所改善。因此,NMN在順鉑和缺血再灌註誘導的AKI中均顯示出對腎臟的有益作用,表明內源性NAD+是AKI治療的潛在靶點。
JNK信號通路在年齡相關的AKI中被激活
基因芯片研究旨在探討年齡相關性AKI易感性的分子機制。在mRNA微陣列中指定接受順鉑或生理鹽水的SIRT1完整或缺陷小鼠的腎皮質樣品作為對照。每組包含三個生物復制品。陣列數據的廣泛通路網路分析指出,在缺乏SIRT1等位基因的情況下,MAPK/JNK信號導致急性腎損傷增加《補充圖5》。微陣列數據通過MAPK通路中三個主要信號模塊的westernblotting進行驗證。與p38或細胞外信號調節激酶1/2《ERK1/2》相比,JNK通過增強JNKAs以及c-JUN和ATF2的磷酸化顯示出強烈的激活《圖8A》。此外,在年齡相關的損傷腎臟中觀察到JNK信號激活《圖8B》。
JNK抑制劑抑制順鉑誘導的HK-2細胞凋亡
為了確定JNK激活是否與SIRT1缺陷增強的細胞損傷相關,我們檢測了JNK抑制劑對細胞存活率和凋亡的影響。與IRT1基因敲除小鼠一致,在培養的HK-2細胞中通過siRNA敲除SIRT1使細胞對順鉑敏感《圖9,A和B》。用SIRT1siRNA轉染或填充RNA的HK-2細胞在暴露於順鉑後顯示凋亡跡象和JNK的磷酸化。與對照組相比,順鉑處理的SIRT1敲除細胞的細胞活力降低,切割的caspase-3蛋白表達增強。SP600125是一種JNK抑制劑,它阻斷了JNK的活化並降低了經抑素處理的HK-2細胞的凋亡《圖9,a和B》。有趣的是,除了JNK抑制劑對順鉑誘導的HK-2細胞凋亡的保護作用外,我們還發現

在無順鉑暴露的SIRT1缺陷細胞中發現磷酸化JNK活化。
SIRT1通過雙特異性磷酸酶16的去乙酰化調節JNK活性
利用針對SIRT1基因不同位點的兩個SIRT1 sirna進一步研究了SIRT1與JNK活性之間的關系。用這兩種siRNA中的任何一種轉染48小時,HK-2細胞中的SIRT1蛋白表達受到抑制《圖9C》。Western印跡顯示JNKwas磷酸化和活化,揭示了ATF2的磷酸化。因為在免疫沉淀實驗中沒有檢測到SIRT1和JNK之間的直接相互作用《數據未顯示》,我們檢測了JNK的上遊磷酸激酶和磷酸酶,因為JNK信號是一個磷酸化依賴的級聯反應。我們研究了MKK7和MKK4這兩種主要的JNK磷酸激酶,它們都是MKK7和MKK4的總形式和磷酸化形式,沒有發現SIRT1缺失的改變《圖9C》。為了探討相關的磷酸酶水平,我們構建了一個flag標記的雙特異性磷酸酶16《DUSP16》質粒,並用SIRT1 siRNA或雜合RNA將其導入HK-2細胞,用免疫沉淀法測定flag-DUSP16的磷酸化和乙酰化水平。當SIRT1被siRNA沉默時,flag-DUSP16的磷酸化被下調,而乙酰化被上調《圖9D》。此外,在HK-2細胞中,SIRT1與DUSP16共沉淀,而不是與其他JNK磷酸酶和磷酸激酶共沉淀《圖9E》。通過反向IP進一步證實了SIRT1和DUSP16之間的相互作用,其中發現flag-DUSP16與SIRT1共沉淀《圖9F,補充圖6A》。這一發現有力地表明,在缺乏SIRT1的情況下,DUSP16將保持乙酰化而不是磷酸化,並失去其磷酸酶活性,從而導致JNK的持續磷酸化。使用賴氨酸-精氨酸突變體DUSP16質粒的附加實驗確定lys462和lys482為DUSP16的乙酰化靶點,因為當轉染lys462和lys482突變體DUSP16質粒時,SIRT1缺陷誘導的JNK磷酸化在HK-2細胞中減弱《補充圖6B》。
圖4。NMN保護腎臟免受順鉑誘導的AKI損傷。用順鉑加或不加NMN治療72小時後《A和B》3-和《C和D》20月齡小鼠的血清BUN和肌酐評估腎功能《PBS治療組n=5-7,NMN治療組n=8-10》。20月齡小鼠腎小管損傷《E》表現為腎切片典型蘇木精伊紅染色和典型ptc電鏡《F和G》,盲法分析《n=5》。比例尺,2 mm。《H》 對切割的caspase-3進行Western印跡分析,並對所示組《n=4–6》進行TUNEL染色和定量。數據以平均6sem表示,並采用兩組間的非配對t檢驗和多組間的方差分析進行分析,然後進行後測。*P、 0.05;**P,0.01;**P,0.001。
討論因素,如對比劑、藥物和外科手術,都可能導致年齡相關的AKI易感性。我們的復雜因素有助於增強對先前研究的易感性,其他研究表明,lonAKI與年齡有關。3糖尿病、高血壓基因SIRT1在保護腎緊張、高脂血症、血管疾病和醫源性損傷方面起著關鍵作用,38本研究確定了SIRT1的底物,–5,36,37 –41
NAD+是老年人AKI易感性增加的重要因素。我們發現,老年腎臟NAD+代謝衰退,SIRT1降低,補充NAD+前體NMN,恢復了NAD+含量和SIRT1活性,挽救了順鉑誘導的急性腎損傷。SIRT1缺乏顯著減弱了NMN的保護作用,表明NMN的腎保護作用依賴於SIRT1。因此,增加內源性NAD+水平可能成為AKI的治療靶點,尤其是在老年人中。
隨著年齡的增長,在蠕蟲、小鼠骨骼肌和肝臟以及人類皮膚組織中檢測到NAD+水平降低,盡管其機制尚不清楚。哺乳動物的NAD+主要由兩種限速酶催化。簡言之,在NMN被NAMPT從煙酰胺轉化為NMN之後,NAD+被NMNAT從NMN轉化而來。34因此,補救途徑中的缺陷可能導致NAD+產生不足。42過度消耗也會導致NAD+缺乏。PARPs和CD38兩種nadase也使用NAD+作為底物,從而消耗NAD+。PARP-1基因敲除與NAD+水平升高相關。43在衰老過程中,由於DNA損傷增加而激活的PARP-1被認為有助於降低衰老器官中的NAD+水平。32,33最近的一項研究表明,在衰老過程中,多個組織中CD38的水平和活性增加,並在與衰老相關的NAD+下降中起重要作用。44在這項研究中,20月齡小鼠的腎皮質中NAMPT和NMNAT的信息RNA表達水平均低於3月齡小鼠,表明NAD的下降+–28
圖5。SIRT1缺乏的腎臟易患AKI。通過《A》BUN和《B》血清肌酐評估指定組的腎功能《生理鹽水治療組n=4,順鉑治療組n=8》。通過順鉑處理的野生型和SIRT1雜合子《n=6》中受損小管的百分比和線粒體密度來評估組織損傷。《E》 接受順鉑治療的SIRT1完整《上圖》和缺陷《下圖》腎臟的代表性蘇木精和伊紅染色切片。右圖顯示順鉑治療的野生型和SIRT1雜合子中代表性腎PTC的EM。比例尺,2 mm。損傷誘導的細胞凋亡通過《F》切割的caspase-3的westernblotting測定,《G》細胞的相對mRNA表達
圖6。NMN對腎臟的作用依賴於SIRT1。通過《A》BUN和《B》肌酐對順鉑治療的SIRT1雜合子進行腎功能評估,無論是否給予NMN《n=7》。用NMN治療的SIRT1雜合子中順鉑誘導的腎損傷的代表性《C》蘇木精和伊紅染色切片和《D》TUNEL染色圖像。組織損傷《E》以損傷小管的百分比評分,並《F》以TUNEL陽性細胞定量《n=4-6》。數據用平均數6sem表示,用非配對t檢驗進行分析。
在增殖細胞和組織中表達,45表明NMNAT可能作為對老年動物代謝減少的適應性反應而降低。值得注意的是,在腎臟中發現了三種nmnat亞型中的兩種:NMNAT1,主要在細胞核中表達,NMNAT3,在線粒體中表達。衰老過程中細胞核和線粒體內NAD+庫的收縮是由NMNAT1和NAT的減少間接引起的
NMNAT3表達,但其亞細胞分佈和NAD+含量的變化尚不清楚。鑒於NAD+能夠在細胞內自由移動,細胞內NAD+水平的降低可能導致使用NAD+作為底物的酶《包括SIRT1》活性的降低。本研究表明,NMN是挽救途徑中NAD+生物合成的中間產物,在順鉑誘導的AKI中補充了衰老腎臟的NAD+水平,使腎臟受益,提示NAD+水平降低與腎臟損傷增強有關,NAD+可能是腎臟保護的重要幹預靶點。
NAD+是SIRT1活性所必需的,SIRT1以前被記錄為一種腎存活因子。38我們研究了NMN的保護作用是否依賴於SIRT1。這項研究表明,腹腔註射NMN可提高年輕和老年腎臟的NAD+水平,這也與SIRT1的活性增加有關,並保護腎臟免受順鉑和缺血再灌註誘導的AKI的影響,表明NMN通過激活SIRT1挽救了AKI。重要的是,補充NMN對SIRT1缺陷小鼠的保護作用顯著減弱,表明NMN的保護作用是通過SIRT1活性產生的。
衰老的生物合成途徑至少部分有助於腎臟中與年齡相關的NAD+減少。NAMPT也是晝夜節律轉錄因子BMAL和CLOCK的主要輸出,隨著年齡的增長,中樞或外周的晝夜節律功能下降可能是導致老年小鼠NAMPT下降的原因。24,42哺乳動物NMNAT被報道是一種重要的機制,其對健康的益處已被廣泛研究。FOXO、PGC1a、NF-kB和HIF已被報道為SIRT1的靶點。46為了確定SIRT1缺陷相關AKI的信號機制,我們采用微陣列方法,使用SIRT1缺陷或完整的小鼠暴露於順鉑或載體。
凋亡相關基因和《H和I》TUNEL分析標記指定組中的凋亡細胞《n=4–6》。數據以平均6sem表示,並采用兩組間的非配對t檢驗和多組間的方差分析進行分析,然後進行後測。*P、 0.05;**P,0.01;**P,0.001。
圖7。NMN對缺血再灌註誘發AKI的腎保護作用。用《A》BUN和《B》血清肌酐評價小鼠缺血再灌註損傷《I/RI》後48小時的腎功能。《C》 腎小管損傷的組織學分析和《D》典型的蘇木精和伊紅染色腎切片顯示《PBS治療組n=6,NMN治療組n=7》。數據用平均數6sem表示,用非配對t檢驗進行分析。*P、 0.05;**P,0.01。
陣列數據表明JNK信號被激活。然後通過westernblotting驗證JNK的激活。由於在損傷組織中觀察到JNK磷酸化,為了檢測JNK激活是否由組織損傷引起,我們在野生型小鼠《30 mg/kg順鉑》和SIRT1缺陷小鼠《20 mg/kg》中誘導了類似的腎損傷,發現雜合子中的JNK磷酸化比野生型小鼠更強烈,這表明JNK激活因SIRT1缺乏而增強《補充圖3》。此外,JNK抑制劑的應用減弱了順鉑誘導的SIRT1完整和缺陷HK-2細胞凋亡。在細胞培養研究中,當siRNA敲除HK-2細胞中SIRT1時,觀察到JNK的激活。然後我們研究了SIRT1影響JNK的機制。我們的i實驗未能找到SIRT1和JNK的直接相互作用。然後我們檢測了JNK的磷酸激酶和磷酸酶,發現DUSP16是SIRT1的潛在靶點。DUSP16屬於有絲分裂原活化蛋白激酶磷酸酶《MKPs》家族,對JNK具有特異性偏好。47 MKPs可誘導並以細胞類型特異性方式迅速作為MAPK級聯反應的反饋環。48此外,MKPs可在轉錄後修飾。在轉染SIRT1 siRNA的HK-2細胞中,我們發現DUSP16的乙酰化和磷酸化增強。鑒於SIRT1是一種去乙酰化酶,除組蛋白外,還針對多種蛋白質,因此在沒有SIRT1的情況下,乙酰化的DUSP16可能存在。更重要的是,通過共免疫沉淀法在HK-2和293T細胞中觀察到SIRT1和DUSP16之間的相互作用。有文獻證明,MKPs的磷酸化狀態與它們的穩定和延長半衰期有關49;因此
圖8。年齡相關性AKI中MAPK/JNK信號通路的激活。《A》 微陣列通過免疫印跡法驗證用生理鹽水或順鉑治療的SIRT1完整和缺陷腎臟中JNK信號的激活。《B》 用生理鹽水、順鉑和PBS或順鉑和NMN處理的3月齡和20月齡小鼠腎皮質中JNK信號蛋白的代表性Western印跡圖像。b-肌動蛋白作為負荷對照。平均6sem測定MAPK信號磷酸化的密度。采用方差分析和後驗分析統計學差異。*P、 0.05;***P,0.001。
SIRT1剝奪中磷酸化的DUSP16可能降低其磷酸酶活性並導致JNK的持續激活。兩種賴氨酸《lys462和lys482》緊密地位於DUSP16蛋白的磷酸化位點serine446附近,提示乙酰化可能與磷酸化競爭並在某些情況下影響蛋白質功能。
總之,腎臟老化與NAD+代謝下降、SIRT1活性降低和AKI易感性增加有關。補充NAD+前體NMN可恢復NAD+和SIRT1水平,並以SIRT1依賴的方式保護腎臟免受年齡相關AKI的影響。這項研究提供的證據表明,恢復內源性NAD+水平的方法是AKI的潛在治療靶點,尤其是在老年人中。
簡明方法
動物
野生型129S2/Sv和C57BL/6小鼠購自Vital River《中國北京》,置於復旦大學醫學動物中心動物設施恒溫室,12小時暗/12小時光圈,允許免費使用標準的嚙齒動物和水特定指示。SIRT11/2miceinC57BL/6背景如前所述產生。5所有動物研究均經復旦大學機構動物護理和使用委員會批準。
AKI的實驗模型
以129S2/Sv背景的3個月齡和20個月齡小鼠、C57BL/6背景的SIRT1雜合子和野生型同窩小鼠為對照,腹腔註射順鉑誘導的AKI模型《順鉑20或30mg/kg;P4392;Sigma-Aldrich,St.Louis,MO》或生理鹽水作為對照。注意micein129背景對順鉑誘導的損傷比C57背景的小鼠更敏感。順鉑暴露72小時後取腎皮質進行進一步研究。為檢測NMN《b-NMN;N3501;Sigma-Aldrich》的作用,連續4天腹腔註射500mg/kg NMN或等量PBS,最後一次註射後4小時處死小鼠。如果小鼠也接受順鉑治療,則在順鉑治療後立即給予第一劑量NMN或PBS。
8-10周前的發熱症-再灌註手術-野生型C57BL/6老鼠。簡單地說,micewerekeptonahomeothermic單位,側面切口。顯露雙側腎蒂,夾閉22分鐘。取出鉗子後,腎臟顏色由深紫色變為粉紅色。再灌註48小時後,讓動物恢復並安樂死。在手術前和再灌註後24小時腹腔註射NMN《500 mg/kg體重》或等量的BSs。
腎功能評價
用尿素氮和肌酐評價腎功能。尿素氮用尿素試劑盒《液體;UV-GLDH法;上海》測定
圖9。SIRT1通過DUSP16的去乙酰化調節JNK信號。用重組RNA或SIRT1-siRNA轉染HK-2細胞,單獨用順鉑、順鉑和SP6000125或順鉑和NMN處理。《A》 對SIRT1、P-JNK和切割的caspase-3進行Western印跡分析。b-肌動蛋白表達作為負荷對照。光密度法測定各組細胞中半胱氨酸天冬氨酸蛋白酶-3的表達。《B》 用CCK-8測定細胞活力《n=3–5》。數據以平均6SEM表示,並使用ANOVA進行分析,然後進行後測。*P、 0.05;**P,0.01。《C》 免疫印跡法檢測HK-2細胞JNK信號轉導及JNK的主要磷酸激酶和磷酸酶
科華生物工程有限公司》。采用5500 QTRAP混合雙四極離子阱質譜儀《AB/SCIEX》根據上述方案分析血清肌酐
腎臟組織學
腎標本用4%多聚甲醛固定,石蠟切片用蘇木精和伊紅染色。每個節段的20多個高功率場以單盲的方式進行了觀察和評分。病理評估以腎小管壞死、脫落、鑄型形成、擴張或細胞腫脹的百分比為基礎。
電子顯微鏡
腎皮質組織用2.5%戊二醛和2.5%多聚甲醛固定在標準加入後加入磷酸鹽緩沖液在透射電鏡下觀察近端腎小管細胞。線粒體密度根據Weibel的形態計量學分析進行估計
TUNEL分析
根據制造商的說明,通過TUNEL分析《G3250;Promega,Fitchburg,WI》檢測凋亡細胞,並通過每個切片10個區域和每個腎臟5個切片中TUNEL陽性細胞的數量進行量化。達皮被反染了。
實時PCR
使用TRIzol試劑《Invitrogen,Carlsbad,CA》從腎組織提取總RNA,並根據制造商的說明《K1622;發酵劑,Thermo Fisher Scientific》使用oligo dTas引物反向轉錄2 mg RNA。使用SYBR綠色預混料試劑盒《RR820;Takara Bio,中國大連》進行實時PCR。以GAPDH為內對照,采用比較法《2》計算目的基因的表達。從引物庫中獲得以下引物:SIRT1正向59-ATGACGCTGTGGCAGATTGTT和反向59-CCGCAAGGCGAGATAGAT,NAMPT正向59AATGTCTCTCTCTCTCTCTCCGGTGT和反向59-GCAACTGGTCTCTCTCATAACACA,NMNAT1正向59-TGGCTCTCTTAACCATCAC和反向59-TCTCTCTCTCTCATCACCAGA,NMNAT3正向59-CCTGTGTTCCTCAACCC和反向59-AGATGTCCCTCAATCACCT,BAX正向59-TGATAGAGAGGGGCCTTTG和反向59-AATTCGCCGGAGACACTCG,caspase-3正向59-ATGGAGAACACACAACCTCAGT和反向59-TTGCTCTCCATGTATGGTCTTTAC,caspase-9正向59-GGCTGTTAAACCCCTACACCA和反向59-TGATGCGCTCAGTCTCTCTACCA,和GAPDH前進59-ACGGCCGCATCTTCTTGTGCA和後退59-TGCCATGCAAATGGCAGCC。2滴滴涕
NAD+測量
根據制造商的說明,使用NAD/NADH定量試劑盒《K337;BioVision,Milpitas,CA》測量腎皮質的NAD+。
蛋白質印跡
使用RIParysisBuffer《P0013B;Beyotime,中國南通》和1:100磷酸酶抑制劑片《德國曼海姆羅氏診斷股份有限公司》、1:100蛋白酶抑制劑雞尾酒片《羅氏》和1:100 mM PMSF《ST506;Beyotime》從冷凍腎組織和培養的HK-2細胞中提取蛋白質。采用Bradford蛋白質分析法測定蛋白質濃度《P0011;Beyotime》。將分離的蛋白質NSDS PAGE電泳轉移至PVDF膜《Millipore,Billerica,MA》並被5%脫脂牛奶或BSA阻斷後,在4℃下使用特異性抗體進行免疫印跡:抗小鼠SIRT1《1:5000;Abcam,劍橋,英國》,抗半胱天冬酶-3《1:500;CST,Danvers,MA》,抗-b-肌動蛋白《1:5000;CST》、抗-ac-P53《1:1000;CST》、抗-ac-Foxo1《1:1000;CST》、抗-P-JNK《1:1000;CST》、抗-JNK《1:1000;CST》、抗-P-p38《1:1000;CST》、抗-p38《1:1000;CST》、抗-P-ERK1/2《1:1000;CST》、抗-P-ATF2《1:1000;CST》、抗-P-cJUN《1:1000;CST》、抗人SIRT1《1:4000;Abcam》,抗磷脂酶《1:1000;Sigma-Aldrich》、抗磷酸/蘇氨酸《1:1000,Abcam》、抗乙酰化賴氨酸《1:1000;CST》、抗MKK7《1:1000;CST》、抗P-MKK7《1:1000;CST》、抗MKK4《1:1000;CST》、抗P-MKK4《1:1000;CST》、抗DUSP3《1:5000;Abcam》和抗DUSP16《1:1000;Abcam》。然後,在室溫下將膜與辣根過氧化物酶結合的抗兔或抗鼠免疫球蛋白孵育1小時。使用化學發光試劑《WBKLS0100;Millipore》和GE ImageQuant LAS 4000對Western印跡上的抗體標記進行可視化。用ImageJ軟件進行密度分析。
SIRT1活性的量化
從腎皮質提取核蛋白,並根據制造商的說明使用市售試劑盒《ab113474用於核蛋白提取;Abcam和ab156915用於SIRT1活性測量;Abcam》量化總SIRT1酶的活性。
免疫沉淀

收集HK-2細胞並在IP緩沖液《20 mM Tris[pH 7.5]、150 mM NaCl、1%Triton X-100、2.5 mM焦磷酸鈉、1 mM b-甘油磷酸鈉、1 mM EDTA、1 mM EGTA、1 mM Na3VO4和1 mg/mlleupeptin》中溶解,添加1:100蛋白酶抑制劑馬尾片《Roche》和1:100 mM PMSF《ST506;Beyotime》。然後,在蛋白裂解液中加入塗有蛋白G plus/蛋白A瓊脂糖珠《IP05;milipore》的抗體進行免疫沉淀
在4°C下保持5小時。內源性SIRT1蛋白用抗SIRT1抗體《Abcam》免疫沉淀,flag-DUSP16用抗flag抗體《Sigma-Aldrich》免疫沉淀,非特異性抗兔或小鼠Ig作為對照。westernblotting檢測免疫沉淀蛋白和輸入。
細胞培養與治療
人乳頭瘤病毒16轉化的人近曲小管細胞《HK-2,CRL-2190》購自美國培養收集《Manassas,VA》,並在37°C的DMEM/F12《Gibco;Thermo Fisher Scientific》中5%CO2氣氛中培養,添加10%FCS、青黴素《100 U/ml》和鏈黴素《100 mg/ml》。在hk-2細胞被sirt1-siRNAorscramble RNA轉染36小時後,將順鉑《25 mm;Sigma-Aldrich》加入含有或不含有SP600125《10 mm;Sigma-Aldrich》的培養基中再持續14小時。取細胞進行凋亡和存活率檢測。
細胞活力測定
如前所述處理24孔培養板中生長的HK-2細胞。然後,使用CCK-8分析《細胞計數試劑盒-8;日本Dojindo》和制造商提供的方案測量細胞活力。實驗在不同治療組的4個重復孔中進行,並獨立重復3次。
RNA幹擾SIRT1基因沉默人SIRT1基因的小幹擾RNA和加擾RNA由geneparma有限公司《蘇州》設計合成。SIRT1 siRNA序列如下:SIRT1512正義的59-ccauccugugucacaautt和反義的59-auuugugagagagagaggtt,sirt1216正義的59-ccaaccugagagagagagaguautt和反義的59-auaucucuuguguguguggtt,以及加擾的RNA正義的59-uucugaaccugugugugucagudtdt和反義的59-acgugaccugagagagagagagagagadtdt。用脂質體2000轉染試劑《Invitrogen》孵育的siRNA轉染HK-2細胞48小時,用SIRT1蛋白免疫印跡法檢測轉染效率。
質粒結構
人DUSP16的flag標記全長cDNA的質粒從Genechem有限公司《中國上海》獲得。總共有7種USP16蛋白的潛在置換位點的賴氨酸通過基於PCR的定點突變被分離並突變為精氨酸。
微陣列
冷凍腎皮質組織《50–100 mg》提交給康晨生物科技公司,使用TRIzol試劑《Invitrogen》提取每個樣本的總RNA,並使用NanoDrop ND-1000分光光度計進行定量;使用標準變性試劑評估RNA完整性segelelectrophoresis.用於顯微陣列分析 樣品制備和微陣列雜交在制造商標準協議的基礎上進行了輕微修改。簡言之,在去除rRNA後從總RNA中純化mRNA《僅mRNA的真核mRNA分離試劑盒;Epicentre》。然後,每個樣本被放大,並用隨機啟動方法轉錄成熒光cRNA,長度在轉錄物的整個長度上,沒有39個偏倚。標記的cRNAs在小鼠陣列YV2.0《8360K;Arraystar》上雜交,清洗載玻片後,用Agilent掃描儀G2505C掃描陣列。
利用Agilent特征提取軟件《11.0.1.1版》對采集到的陣列圖像進行分析。使用Limma軟件包進行分位數歸一化和隨後的數據處理。根據KEGG數據庫對差異表達的具有統計學意義的mRNAs進行鑒定和註釋,以定位最受影響的信號通路。然後,將前50條不同的通路整合到Pathway-Act網路中,以闡明核心信號通路。
統計分析
所有數值均用平均值6SEM表示,並用GraphPad Prism 6進行分析,采用非配對Student t檢驗或事後方差分析分析采用Fisher精確檢驗對微陣列數據進行分析。P,0.05被認為是顯著的。
致謝
感謝尹慧勇《中國科學院上海生物科學研究所》對小鼠血清肌酐測定的幫助。
本研究得到國家自然科學基金項目31471101、81520108006、81130075和國家基礎研究計劃973項目2012CB517704、985項目985Ⅲ-YFX0302的資助。
以上內容由康特生物科技有限公司為研究康特NMN提供的內部資料,僅供學習參考